Çözünme Olayı Nasıl Olur?
13 Mayıs 2011 Cuma
 Çözünme Olayı :
Çözünme Olayı :Çözücü ve çözünen maddelerin birbiri içerisinde iyonlarına veya moleküllerine kadar ayrılmasına çözünme denir.
Bir maddenin moleküllerinin veya iyonlarının, diğer maddenin moleküllerinin veya iyonlarının arasına girmesine çözünme denir.
Çözünme olayında;
• Çözücü ve çözünen maddeleri oluşturan tanecikler yani moleküller veya iyonlar çözünme olayı gerçekleşmeden önce birbirlerine çok yakındır.
• Çözücü maddelerin tanecikleri ile çözünen maddelerin tanecikleri yani molekülleri veya iyonları etkileşir.
• Çözünme olayında, çözücü ve çözünen maddenin tanecikleri yani molekülleri veya iyonları arasında elektron alış verişi veya ortaklaşması gerçekleşmediği için çözücü ve çözünen madde sadece fiziksel değişime uğrar, kimyasal değişime uğramaz ve maddelerin kimliklerinde değişme meydana gelmez.
• Çözünme sonrasında, çözücü ve çözünen tanecikleri birbirlerinin etrafını sardığı için çözücü ve çözünen tanecikleri çözeltinin her tarafında eşit miktarda bulunur.
• Çözücü madde tanecikleri, çözünen madde taneciklerinin etrafını sardığı için çözücü maddenin tanecikleri de birbirinden ayrılır.
• Çözünen madde moleküler yapılı ise, çözücü maddenin molekülleri, çözünen maddenin moleküllerinin arasına girerek çözünen maddenin moleküllerinin etrafını sarar ve çözünen maddenin moleküllerine kadar ayrılmasını sağlar. Ayrılan moleküller çözücünün her tarafına eşit oranda dağılır.
• Çözünen madde iyonik yapılı ise, çözücü maddenin molekülleri, çözünen maddenin (+) ve (–) iyonlarının arasındaki iyonik bağı zayıflatır ve (+) ve (–) iyonlar birbirinden ayrılır. Çözücü maddenin molekülleri, ayrılan (+) ve (–) iyonların arasına girerek bu iyonların etrafını sarar ve çözünen maddenin iyonlarına kadar ayrılmasını sağlar. Ayrılan iyonlar çözücünün her tarafına eşit oranda dağılır.
Örnekler :
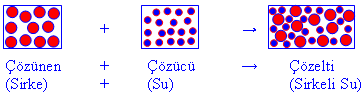
1- Su – sirke çözeltisinde, çözünen olan sirke, moleküler yapılı maddedir. Çözücü olan su molekülleri, çözünen olan sirke moleküllerinin etrafını sararak sirke moleküllerinin birbirinden uzaklaşmasını yani çözünmesini sağlar.
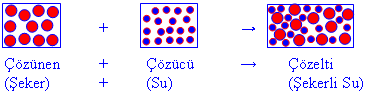
2- Su – şeker çözeltisinde, çözünen olan şeker, moleküler yapılı maddedir. Çözücü olan su molekülleri, çözünen olan şeker moleküllerinin etrafını sararak şeker moleküllerinin birbirinden uzaklaşmasını yani çözünmesini sağlar.
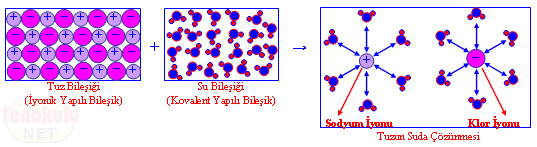
3- Su – tuz çözeltisinde, çözünen olan tuz iyonik yapılı maddedir. Çözücü olan su molekülleri, çözünen olan tuz bileşiğindeki (+) ve (–) iyonlar arasındaki iyonik bağı zayıflatır ve (+) yüklü Na iyonu ile (–) yüklü Cl iyonlarının arasına girerek bu iyonların birbirinden ayrılmasını yani çözünmesini sağlar.
NOT :
1- Aynı miktarda çözücü ve çözünen maddenin kullanıldığı çözeltilerde, maddelerden
hangisinin çözücü, hangisinin çözünen olduğu, çözücü ve çözünen maddenin taneciklerinin davranışlarına göre belirlenir.
2- Toprak bir karışımdır ve toprakta birçok iyonik madde bulunur. Yağmur suları topraktan akarken topraktaki bazı maddeler suda çözünür ve bu maddeler iyonlarına ayrılır. Bu nedenle içilen veya göl, baraj gibi yerlerde biriken sular saf su olmayıp çeşitli iyonlar bulundurur. Bu nedenle yağmur suları elektrolit çözelti olarak kabul edilir ve yüksek elektrik enerjisi altında yalıtkan olan saf su, çözelti haline geldikten sonra iletken hale geçer.
3- Elektrik tellerinin kopup suya veya ıslak toprağa temas ettiği yerlerde elektrik çarpma tehlikesi olabilir. Bu nedenle yağmur yağarken açık alanda elektrik direklerine yaklaşmak tehlikelidir.
9- Çözünme Hızına Etki Eden Faktörler :
Çözücünün çözünme hızının artması için, çözücü moleküllerinin birim zamanda daha fazla çözünen molekülünün veya iyonunun etrafını sarması gerekir.
a) Sıcaklık :
Çözeltilerde, sıcaklığın arttırılması, katı ve sıvı haldeki maddelerin çözünme hızını arttırır, gaz çözünen maddenin çözünme hızını azaltır.
Sıcaklık arttırıldığında çözücü ve çözünen maddeyi oluşturan taneciklerin hızları artar. Hızlı hareket eden çözücü maddenin tanecikleri, çözünen maddenin taneciklerin etrafını daha hızlı sararak çözünme olayını hızlandırır.
b) Tanecik Boyutunu Küçültme :
Çözeltilerde, çözünen maddenin tanecik boyutunun küçültülmesi, yani maddenin ufalanıp toz haline getirilmesi katı haldeki maddelerin çözünme hızını arttırır.
Çözünen maddenin tanecik boyutu küçültüldüğünde, çözücü maddenin tanecikleri, daha fazla çözünen maddenin taneciği ile temas eder yani etrafını sarar ve bu nedenle çözünme olayı hızlanır.
c) Sallama, Karıştırma :
Katı ve sıvıların çözünme hızını arttırır, gazlarınkini azaltır.
d) Basınç Artışı :
Katı ve sıvıların çözünme hızına etki etmez,gazların çözünme hızını arttırır.
e) Çözücü Miktarı :
Çözücü miktarı artarsa genelde çözünme hızı artar.
f) Çözünen Miktarı :
Çözünen miktarı artarsa genelde çözünme hızı azalır.
10- Çözünme Miktarına (Çözünürlüğe) Etki Eden Faktörler :
a) Sıcaklık :
Sıcaklık arttıkça katıların çözünme miktarı (çözünürlüğü) genellikle artar, gazların çözünürlüğü azalır.
b) Basınç :
Katı ve sıvıların çözünme miktarına (çözünürlüğüne) etki etmez. Basınç arttıkça gazların çözünürlüğü artar. (Katılar sıkıştırılamadığı için). (Henry Yasası).
c) Çözücünün Cinsi :
Katı, sıvı ve gazların çözünme miktarını (çözünürlüğünü) etkiler.
d) Çözünenin Cinsi :
Katı, sıvı ve gazların çözünme miktarını (çözünürlüğünü) etkiler.
e) Sallama, Karıştırma :
Katı ve sıvıların çözünme miktarını (çözünürlüğünü) etkilemez.
f) Tanecik Boyutunu Küçültme :
Katı ve sıvıların çözünme miktarını (çözünürlüğünü) etkilemez.
NOT :
1- Çözünme hızına etki eden sallama, karıştırma, toz haline getirme sadece çözünme
hızını etkiler ama çözünme (çözünürlük) miktarını etkilemez.
2- Çözeltide (katı–sıvı çözeltilerinde) çözünen madde miktarı artarsa çözeltinin kaynama sıcaklığı yükselir, donma sıcaklığı düşer.
3- Katı maddelerin çözünme miktarı genelde sıcaklık arttıkça artar. Ama Li2CO3 ve Na2SO4’ın oluşturduğu çözeltilerin çözünme miktarı sıcaklık arttıkça azalır.
(Le Chatelier bulmuştur)
Kaynak: İlginizi Çekecek Güzel Haberler Oyunlar ve fazlası
 Google da bu haberi ara
Google da bu haberi ara
Etiketler:
Çözünme Olayı Nasıl Olur?











Yorum Gönder